I beta-bloccanti rappresentano uno dei pilastri della terapia cardiovascolare, utilizzati da oltre mezzo secolo nel trattamento di condizioni come l’ipertensione arteriosa, lo scompenso cardiaco, le aritmie e la prevenzione secondaria dopo un infarto miocardico. La loro capacità di ridurre la mortalità e migliorare la qualità di vita in pazienti con patologie cardiache è ampiamente documentata.
Oltre all’ambito cardiologico, questi farmaci trovano impiego in neurologia (nella profilassi dell’emicrania) e in psichiatria (per gestire sintomi d’ansia o tremori), dimostrando una versatilità che ne conferma l’importanza nella pratica clinica.
Tuttavia, un’ombra ha accompagnato a lungo la reputazione dei beta-bloccanti: il sospetto che possano indurre o peggiorare i disturbi depressivi. Dagli anni ’60, casi isolati e segnalazioni aneddotiche hanno alimentato l’idea che farmaci come il propranololo, noto per la sua capacità di attraversare la barriera ematoencefalica, fossero associati a sintomi neuropsichiatrici.
La paura di scatenare depressione ha portato a una sotto-prescrizione di questi farmaci, soprattutto in pazienti con vulnerabilità pregressa, con possibili ripercussioni negative sulla gestione delle patologie cardiovascolari.
In un’epoca in cui le malattie cardiovascolari rimangono la prima causa di morte globale, comprendere la reale portata di questo presunto effetto collaterale diventa cruciale per ottimizzare le scelte terapeutiche.
Questo articolo si propone di fare chiarezza su uno dei dilemmi più persistenti nella medicina moderna: esiste davvero un legame causale tra beta-bloccanti e depressione?
Attraverso un’analisi critica delle evidenze scientifiche più recenti, verranno esaminati i dati emersi da studi clinici, revisioni sistematiche e indagini epidemiologiche su larga scala.
Punti Principali:
- Origine del mito: Negli anni ’60-’80 emersero le prime osservazioni aneddotiche di un possibile legame tra beta-bloccanti e depressione, ma queste presentavano importanti limiti metodologici.
- Ipotesi neurobiologiche: Si è ipotizzato che i beta-bloccanti potessero influenzare l’umore attraverso l’interazione con i recettori cerebrali e gli effetti sul ritmo circadiano.
- Fattori confondenti: Il bias protopatico e l’uso dei beta-bloccanti in situazioni neuropsichiatriche hanno contribuito a creare una falsa associazione con la depressione.
- Evidenze scientifiche recenti: Meta-analisi e studi su larga scala non hanno confermato un nesso causale tra beta-bloccanti e depressione, sfatando il mito precedente.
- Implicazioni cliniche: Le linee guida attuali non controindicano l’uso di beta-bloccanti nei pazienti con storia di depressione, ma raccomandano un attento monitoraggio.

Origini del Mito: Casi Storici e Prime Segnalazioni
Il dibattito sul possibile legame tra beta-bloccanti e depressione ha radici profonde, risalenti agli albori dell’utilizzo di questi farmaci in ambito cardiovascolare. Questo capitolo esplora le prime osservazioni che hanno dato vita a questa controversia, evidenziando al contempo i limiti metodologici che hanno caratterizzato queste segnalazioni iniziali.
Prime osservazioni aneddotiche (anni ’60-’80)
La storia del presunto legame tra beta-bloccanti e depressione inizia nel 1967, quando un medico olandese pubblicò un’osservazione clinica che avrebbe influenzato la percezione di questi farmaci per decenni. Il caso riguardava un gruppo di pazienti ipertesi trattati con propranololo, un beta-bloccante altamente lipofilo, tra i quali si era riscontrata un’incidenza sorprendentemente elevata di sintomi depressivi.
Questa segnalazione aprì le porte a una serie di report simili nei due decenni successivi. Medici di varie specialità iniziarono a riportare casi di pazienti che, dopo l’inizio della terapia con beta-bloccanti, manifestavano una costellazione di sintomi neuropsichiatrici. Tra questi, i più frequentemente citati erano:
- Insonnia o alterazioni del ritmo sonno-veglia
- Incubi e sogni vividi
- Astenia e faticabilità
- Cambiamenti dell’umore, con tendenza alla tristezza
Questi sintomi sembravano emergere poco dopo l’inizio della terapia e, in molti casi, si risolvevano con la sospensione del farmaco, per poi ricomparire alla sua reintroduzione. Tale pattern temporale rafforzò l’ipotesi di un nesso causale tra l’uso di beta-bloccanti e depressione.
Limiti delle prime evidenze
Nonostante l’impatto significativo che queste prime segnalazioni ebbero sulla comunità medica, è importante sottolineare i limiti metodologici che le caratterizzavano:
- Assenza di gruppi di controllo: La maggior parte di queste osservazioni erano case report o serie di casi, prive di un gruppo di confronto. Ciò rendeva impossibile determinare se l’incidenza di depressione fosse effettivamente più alta nei pazienti trattati con beta-bloccanti rispetto alla popolazione generale o ad altri pazienti con patologie cardiovascolari.
- Bias di selezione: I medici, allertati dalle prime segnalazioni, potrebbero aver prestato maggiore attenzione ai sintomi depressivi nei pazienti trattati con beta-bloccanti, portando a una sovrastima del fenomeno.
- Confusione tra sintomi somatici e depressione maggiore: Molti dei sintomi riportati, come astenia e disturbi del sonno, sono comuni effetti collaterali dei beta-bloccanti ma sono anche sintomi aspecifici che possono far parte del quadro clinico della depressione. Questa sovrapposizione sintomatologica potrebbe aver portato a una sovradiagnosi di depressione in pazienti che manifestavano effetti collaterali comuni del farmaco.
- Mancata considerazione di fattori confondenti: Le patologie cardiovascolari stesse, così come lo stress legato a una nuova diagnosi o all’inizio di una terapia, possono influenzare l’umore. Questi fattori non venivano adeguatamente considerati nelle prime segnalazioni.
Meccanismi dell’Associazione Beta-bloccanti e Depressione
Ipotesi neurobiologiche
La presunta associazione tra beta-bloccanti e depressione ha stimolato diverse ipotesi sui possibili meccanismi neurobiologici sottostanti. Queste teorie si concentrano principalmente su due aspetti: l’interazione diretta dei farmaci con i recettori cerebrali e gli effetti indiretti sul ritmo circadiano.
Blocco dei recettori β-adrenergici centrali
Una delle ipotesi principali riguarda la capacità dei beta-bloccanti di attraversare la barriera emato-encefalica e interagire con i recettori β-adrenergici presenti nel sistema nervoso centrale. In questo contesto, la lipofilia del farmaco gioca un ruolo cruciale.
Molecole altamente lipofile come il propranololo penetrano più facilmente nel tessuto cerebrale rispetto a composti idrofili come l’atenololo. Questa differenza potrebbe spiegare perché alcuni beta-bloccanti sembrano avere un impatto maggiore sull’umore rispetto ad altri.
Una volta nel cervello, si ipotizza che i beta-bloccanti possano modulare i livelli di neurotrasmettitori chiave come la noradrenalina e la serotonina. Alterazioni in questi sistemi sono notoriamente coinvolte nella patogenesi della depressione. Il blocco dei recettori β potrebbe portare a una diminuzione dell’attività noradrenergica, potenzialmente contribuendo a sintomi depressivi.
Effetti sul ritmo circadiano
Un’altra ipotesi interessante riguarda l’impatto dei beta-bloccanti sul ritmo circadiano. Questi farmaci possono ridurre la produzione di melatonina, l’ormone che regola il ciclo sonno-veglia. Una diminuzione della melatonina potrebbe portare ad alterazioni del sonno, un sintomo frequentemente associato alla depressione. Inoltre, disturbi del ritmo circadiano sono sempre più riconosciuti come fattori di rischio per lo sviluppo di disturbi dell’umore.
Fattori confondenti e bias protopatico
Nonostante queste ipotesi biologicamente plausibili, è fondamentale considerare i potenziali fattori confondenti che potrebbero spiegare l’apparente associazione tra beta-bloccanti e depressione.
Sintomi preesistenti non diagnosticati
Molti pazienti che iniziano una terapia con beta-bloccanti potrebbero già presentare sintomi ansiosi o depressivi subclinici non ancora diagnosticati. L’inizio del trattamento potrebbe coincidere con il momento in cui questi sintomi diventano clinicamente evidenti, creando l’illusione di una relazione causale.
Uso in situazioni neuropsichiatriche
Il bias protopatico rappresenta un errore interpretativo che si verifica quando un farmaco viene prescritto per sintomi iniziali di una patologia non ancora riconosciuta. In pratica, il trattamento viene avviato per manifestazioni che in realtà sono i prodromi di una malattia più complessa, creando l’illusione che sia il farmaco stesso a causare la patologia quando questa emerge successivamente.
Questo fenomeno distorce la percezione della relazione causale, poiché l’ordine temporale (prima il farmaco, poi la diagnosi) simula un nesso inesistente.
Il caso emblematico è quello del propranololo, beta-bloccante lipofilo ampiamente utilizzato in ambito neuropsichiatrico. Questo farmaco viene spesso impiegato per gestire ansia, tremori essenziali o emicrania, sintomi che possono costituire i primi segnali di un disturbo depressivo in fase iniziale. Quando successivamente viene diagnosticata la depressione, si tende erroneamente ad attribuire la colpa al farmaco, mentre in realtà l’ansia o i tremori rappresentavano già le avvisaglie del disturbo dell’umore non ancora identificato.
Le evidenze epidemiologiche, di cui parleremo in dettaglio qui sotto, hannno chiarito questo meccanismo. Uno studiodel 2022 ha dimostrato che i pazienti in terapia con propranololo per indicazioni neuropsichiatriche presentavano un rischio di depressione sei volte superiore rispetto ai non utilizzatori, mentre chi lo assumeva per patologie cardiovascolari mostrava solo un lieve incremento del rischio. Questo dato suggerisce che l’aumentato rischio non dipende dal farmaco in sé, ma dalla condizione clinica sottostante per cui viene prescritto.
Una meta-analisi ha ulteriormente corroborato questa tesi, evidenziando come i beta-bloccanti utilizzati in ambito cardiologico non mostrassero alcuna associazione con la depressione. L’eccezione del propranololo si spiega proprio con il suo impiego preferenziale in contesti dove i sintomi trattati (come l’ansia) possono evolvere o mascherare un quadro depressivo emergente.
Analisi Critica delle Evidenze Scientifiche
Il percorso scientifico sul legame tra beta-bloccanti e depressione è un esempio emblematico di come le prime osservazioni aneddotiche possano generare equivoci duraturi. Gli studi più rigorosi e ampi, inclusi quelli recenti, concordano nel ritenere infondata l’associazione causale. L’eccezione del propranololo in ambito neuropsichiatrico non è un effetto farmacologico, ma una distorsione legata alla complessità delle condizioni trattate. Per i clinici, il messaggio è chiaro: i benefici cardioprotettivi dei beta-bloccanti non devono essere compromessi da timori non supportati dalle evidenze.
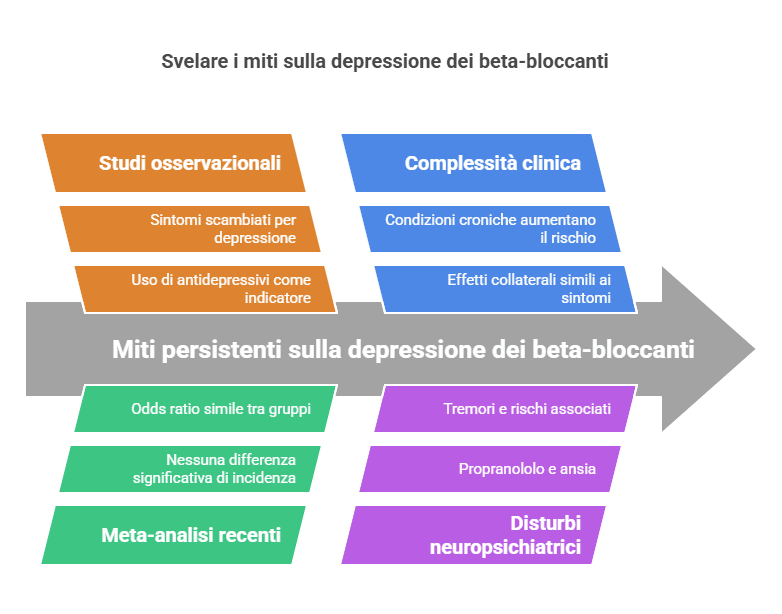
Studi osservazionali e trial storici
Nei primi anni ’80, alcuni studi osservazionali sollevarono il sospetto che i beta-bloccanti potessero influenzare l’umore. Un’indagine condotta su pazienti ipertesi riportò un aumento delle prescrizioni di antidepressivi tra chi assumeva questi farmaci. Tuttavia, questa correlazione si rivelò presto problematica: l’uso di antidepressivi come indicatore di depressione era un indicatore indiretto poco specifico. Gli antidepressivi, infatti, sono prescritti anche per disturbi d’ansia, insonnia o dolori neuropatici, rendendo difficile distinguere se l’aumento fosse davvero legato a sintomi depressivi.
Nei pazienti cardiologici (es. ipertesi), sintomi come affaticamento, insonnia o ridotta energia – comuni effetti collaterali dei beta-bloccanti – possono essere scambiati per depressione. Di conseguenza, i medici prescrissero antidepressivi per gestire questi sintomi aspecifici, senza che vi sia un vero disturbo depressivo sottostante.
Inoltre, molti pazienti cardiologici già soffrivano di condizioni croniche, come ipertensione o scompenso cardiaco, che di per sé aumentano il rischio di sviluppare depressione. Questo limite metodologico aprì la strada a interpretazioni errate, alimentando un dibattito che si protrasse per decenni.
Meta-analisi e revisioni sistematiche
Con l’accumularsi di dati, le revisioni scientifiche hanno offerto una prospettiva più equilibrata. Tra le più significative, una meta-analisi che analizzò 15 trial clinici randomizzati non trovò differenze statisticamente rilevanti nell’incidenza di depressione tra chi assumeva beta-bloccanti e chi riceveva placebo. Successivamente, un’analisi ancora più ampia del 2021, che coinvolse oltre 53.000 pazienti, confermò questi risultati: il rischio di sviluppare depressione era praticamente identico tra i due gruppi (odds ratio 1.02).
Questi studi evidenziarono anche che, sebbene disturbi del sonno o incubi fossero più frequenti con alcuni beta-bloccanti, non esisteva un nesso causale con la depressione maggiore.
Un punto cruciale emerso da queste ricerche è la differenza tra percezione soggettiva dei sintomi e diagnosi clinica. Molti effetti collaterali dei beta-bloccanti – come affaticamento o ridotta energia – possono essere scambiati per segnali di depressione, ma non equivalgono a un disturbo dell’umore conclamato. Inoltre, la maggior parte degli studi storici non teneva conto di fattori confondenti come lo stress legato alla malattia cardiaca stessa, che può influenzare indipendentemente il benessere psicologico.
Studi di popolazione recenti
Le ricerche più recenti hanno aggiunto un tassello fondamentale, sfatando definitivamente molti miti. Uno studio su larga scala condotto su quasi 120.000 individui ha dimostrato che il rischio di depressione era aumentato solo in un gruppo specifico: i pazienti che assumevano propranololo per disturbi neuropsichiatrici (come ansia o tremori). In questi casi, l’odds ratio saliva a 6.33, ma l’analisi approfondita rivelò che l’aumento non era dovuto al farmaco stesso, bensì alla condizione di base per cui era prescritto. In altre parole, sintomi come l’ansia o il tremore essenziale potevano essere precursori o componenti di un quadro depressivo non ancora diagnosticato, un fenomeno noto come bias protopatico di cui si è accennato più sopra a proposito dei fatotri confondenti.
Al contrario, in chi assumeva beta-bloccanti per patologie cardiovascolari, il rischio di depressione era marginale. Addirittura, alcuni studi danesi hanno suggerito un possibile effetto protettivo di farmaci come il carvedilolo o il bisoprololo, ipotizzando che il miglioramento della funzione cardiaca e della qualità di vita potesse ridurre il carico emotivo associato alle malattie croniche.
Fattori Chiave nell’Interpretazione dei Risultati
Lipofilia e penetrazione cerebrale
Per anni si è ipotizzato che la capacità dei beta-bloccanti di attraversare la barriera ematoencefalica – legata alla loro lipofilia – potesse aumentare il rischio di effetti neuropsichiatrici come la depressione. Tuttavia, i dati più recenti sfidano questa convinzione. Beta-bloccanti altamente lipofili come carvedilolo e nebivololo, ampiamente utilizzati in cardiologia, non mostrano un aumento significativo del rischio depressivo rispetto ai farmaci idrofili.
L’eccezione è stata rappresentata per anni dal propranololo, storicamente associato a segnalazioni di sintomi depressivi. Tuttavia, questa correlazione come abbiamo visto va reinterpretata alla luce dei nuovi studi epidemiologici: il propranololo è spesso prescritto per indicazioni neuropsichiatriche (come emicrania, tremori o ansia), condizioni che di per sé possono essere precursori o componenti di un quadro depressivo non ancora diagnosticato. In altre parole, non è la lipofilia del farmaco a causare depressione, ma il contesto clinico in cui viene utilizzato.
Impatto delle comorbidità e del contesto clinico
Il profilo di rischio dei beta-bloccanti varia notevolmente a seconda della popolazione studiata:
- Pazienti cardiologici (ipertesi, scompenso cardiaco, post-infarto): in questi casi, sintomi come affaticamento, insonnia o ridotta energia – effetti collaterali comuni dei beta-bloccanti – possono essere erroneamente attribuiti a depressione. L’astenia post-infarto, ad esempio, è un fenomeno fisiologico legato alla ridotta perfusione cardiaca, ma potrebbe essere scambiato per un sintomo depressivo se non valutato correttamente.
- Pazienti neurologici/psichiatrici: chi assume beta-bloccanti per ansia, tremori o emicrania presenta un rischio apparentemente maggiore di depressione. Tuttavia, come detto prima studi su larga scala dimostrano che questo aumento è legato alla condizione di base (es. disturbi d’ansia non diagnosticati) piuttosto che al farmaco stesso.
Un ulteriore fattore confondente è la sovrapposizione sintomatologica tra effetti collaterali fisici dei beta-bloccanti e manifestazioni depressive. La sonnolenza diurna, gli incubi o la ridotta libido – comuni durante la terapia – potrebbero essere interpretati come segnali di depressione, soprattutto in assenza di strumenti diagnostici specifici.
Implicazioni per la Pratica Clinica

Linee guida attuali e raccomandazioni
Le recenti linee guida della Società Europea di Cardiologia (ESC) del 2021 hanno fatto chiarezza su un punto cruciale: i beta-bloccanti non sono controindicati nei pazienti con una storia di depressione. Questa affermazione, basata su un’attenta revisione delle evidenze scientifiche accumulate negli ultimi decenni, rappresenta un importante cambio di paradigma rispetto al passato.
Per molto tempo, infatti, la preoccupazione di indurre o peggiorare sintomi depressivi ha portato molti clinici a essere riluttanti nel prescrivere beta-bloccanti a pazienti con una storia di disturbi dell’umore. Le nuove linee guida, tuttavia, rassicurano i medici sulla sicurezza di questi farmaci dal punto di vista psichiatrico, incoraggiandone l’uso quando clinicamente indicato.
Ciononostante, le linee guida sottolineano l’importanza di un attento monitoraggio, soprattutto nelle fasi iniziali della terapia. In particolare, si raccomanda di prestare attenzione alla comparsa di sintomi aspecifici come insonnia e stanchezza. Questi disturbi, pur non essendo necessariamente indicativi di depressione, potrebbero influire negativamente sulla qualità di vita del paziente e sulla sua aderenza alla terapia.
È importante notare che sintomi come affaticamento e disturbi del sonno sono effetti collaterali comuni dei beta-bloccanti, soprattutto all’inizio del trattamento. Nella maggior parte dei casi, tendono a attenuarsi con il tempo. Tuttavia, se persistenti o particolarmente fastidiosi, potrebbero richiedere un aggiustamento della dose o un cambio di farmaco.
Gestione del paziente complesso
Nei pazienti con una storia di disturbi depressivi o ansiosi, è fondamentale un approccio individualizzato. L’identificazione precoce di sintomi depressivi e il monitoraggio costante possono aiutare a bilanciare i benefici cardiovascolari dei beta-bloccanti con il possibile rischio di effetti collaterali psichiatrici. Inoltre, strategie come l’uso di farmaci meno lipofili o la modulazione del dosaggio possono ridurre l’impatto su umore e cognizione.
Scelta del farmaco
La selezione del beta-bloccante in pazienti con vulnerabilità psicologica deve privilegiare l’efficacia cardiovascolare, senza compromettere la tollerabilità. Come abbiamo visto le evidenze scientifiche più recenti, concordano nel ritenere infondato il nesso causale tra beta-bloccanti e depressione, indipendentemente dalla lipofilia. Tuttavia, alcune raccomandazioni pratiche ottimizzano la terapia:
- Propranololo: va riservato a contesti specifici, come la profilassi dell’emicrania o il controllo del tremore essenziale. La lipofilia non è un criterio discriminante. I beta-bloccanti vanno scelti in base all’indicazione clinica, senza timori ingiustificati. L’eccezione del propranololo in ambito neuropsichiatrico richiede attenzione ai sintomi precoci di depressione, ma non giustifica la rinuncia a terapie salvavita: in pazienti con vulnerabilità psichiatrica preesistente è preferibile scegliere beta-bloccanti cardioselettivi (es. bisoprololo) o con minore penetrazione cerebrale (es. atenololo), non per sicurezza farmacologica, ma per evitare diagnosi errate.
- Beta-bloccanti cardioselettivi (es. bisoprololo, nebivololo): sono sicuri anche a lungo termine, con profili neuropsichiatrici neutrali. La cardioselettività riduce effetti collaterali come broncospasmo, favorendo l’aderenza.
- Carvedilolo e nebivololo: nonostante la lipofilia, studi clinici (CIBIS II, MERIT-HF) dimostrano un impatto neutro o protettivo sull’umore, grazie a proprietà vasodilatatorie e antiossidanti. Sono preferibili nello scompenso cardiaco, dove riducono la mortalità del 35-65%.

Comunicazione medico-paziente
La percezione di un legame tra beta-bloccanti e depressione rimane radicata, influenzando l’aderenza terapeutica. Strategie efficaci includono:
- Sfatare miti: Spiegare che gli studi su migliaia di pazienti non supportano un rischio aumentato di depressione, salvo casi isolati legati a contesti specifici.
- Educare sui sintomi aspecifici: Affaticamento, insonnia o incubi possono essere effetti collaterali transitori, non segni di depressione. Monitorarli senza allarmismi.
- Coinvolgere il paziente nelle decisioni: Discutere i benefici cardioprotettivi (riduzione del 30-35% della mortalità nello scompenso) rispetto a timori spesso infondati.
- Gestire le comorbidità: In pazienti con ansia o storia psichiatrica, preferire beta-bloccanti a emivita breve e avviare un follow-up strutturato per valutare l’impatto sulla qualità di vita.
Vignetta Cinica: Alessandra, la paziente con ansia generalizzata e paura della malattia
Alessandra, 45 anni, è una paziente con ipertensione lieve e frequenti episodi di tachicardia sinusale, spesso innescati da situazioni di stress. Riferisce anche una sensazione di “mancanza d’aria”, tensione muscolare e difficoltà a rilassarsi. Ha eseguito più volte ECG ed ecocardiogramma, tutti negativi per patologie strutturali. Dopo una serie di consulti cardiologici, le viene consigliato l’uso di un beta-bloccante per controllare la tachicardia, ma la paziente esprime grande preoccupazione: ha letto che i beta-bloccanti “fanno venire la depressione” e teme di sentirsi “spenta” o “senza energie”.
Ragionamento Clinico e Scelta Terapeutica:
Il primo passo è distinguere se la tachicardia della paziente è primariamente legata a una condizione cardiaca strutturale o se è di natura funzionale. In questo caso, la storia clinica, gli esami strumentali negativi e il contesto psicologico suggeriscono una tachicardia sinusale inappropriata con forte componente ansiosa. Tuttavia, il sintomo rimane di pertinenza cardiologica e deve essere trattato per migliorare la qualità di vita della paziente e ridurre il circolo vizioso ansia-tachicardia.
I beta-bloccanti sono una scelta indicata per:
- Ridurre la frequenza cardiaca e il consumo di ossigeno miocardico, migliorando la sintomatologia.
- Modulare la risposta adrenergica esagerata tipica dell’ansia somatizzata.
- Migliorare i sintomi fisici dell’ansia (palpitazioni, tremori, sudorazione), aiutando così anche il controllo emotivo indiretto.
Tra i beta-bloccanti disponibili, il propranololo è quello con la maggiore evidenza nel controllo delle manifestazioni fisiche dell’ansia, ed è frequentemente impiegato anche nei disturbi d’ansia da prestazione.
Gestione della preoccupazione per la depressione
La paura del clinico e/o della paziente di sviluppare depressione con il beta-bloccante deve essere affrontata con serenità. È importante spiegare che:
- I dati scientifici non supportano un’associazione causale tra beta-bloccanti e depressione.
- Il propranololo è usato anche per ridurre l’ansia, e non solo per la tachicardia. Molti pazienti con ansia riferiscono un miglioramento del benessere generale proprio grazie all’effetto stabilizzante sulla risposta adrenergica.
- L’ansia stessa può generare sintomi depressivi e, paradossalmente, il miglior controllo della tachicardia potrebbe ridurre il rischio di sviluppare umore deflesso.
A questo punto, il medico deve ricordare il concetto di bias protopatico, ovvero la possibilità che la correlazione tra beta-bloccanti e depressione sia in realtà dovuta al fatto che questi farmaci vengono prescritti proprio in pazienti che già hanno un substrato ansioso o una vulnerabilità psicologica.
Se la paziente dovesse sviluppare sintomi depressivi durante la terapia, è importante valutarli nel contesto più ampio del suo quadro clinico e non attribuirli automaticamente al farmaco.
Monitoraggio e Follow-Up
Per garantire la miglior esperienza terapeutica, si concorda un piano di monitoraggio:
- Inizio della terapia con basse dosi (es. 10-20 mg di propranololo al bisogno o 20-40 mg in somministrazione regolare).
- Follow-up a 2-4 settimane per valutare la risposta e l’eventuale comparsa di effetti collaterali.
- Attenzione a segnali di affaticamento e umore deflesso, con la consapevolezza che potrebbero essere legati a una riduzione fisiologica dell’attivazione adrenergica e non a una vera depressione.
Dopo un mese, Alessandra riferisce un significativo miglioramento della tachicardia e della sensazione di “mancanza d’aria”. Si sente più tranquilla e ha meno paura degli episodi di tachicardia, il che ha ridotto il circolo vizioso ansia-sintomi. Non ha riportato sintomi depressivi, anzi, afferma di sentirsi più rilassata.
Direzioni Future e Ricerca
La relazione tra beta-bloccanti e sintomi neuropsichiatrici, sebbene approfonditamente indagata, presenta ancora numerose aree di incertezza che richiedono studi futuri più mirati. In particolare, tre direzioni di ricerca emergono come essenziali per migliorare la gestione clinica e la personalizzazione della terapia.
1-Studi prospettici su popolazioni specifiche
Uno degli ambiti più critici riguarda i pazienti con una storia pregressa di disturbi d’ansia o depressione. Attualmente, i dati disponibili su questi soggetti sono limitati, rendendo difficile distinguere se eventuali peggioramenti dell’umore siano imputabili al farmaco o a una naturale evoluzione della patologia di base. Studi longitudinali, incentrati su questi pazienti, potrebbero fornire risposte più chiare, valutando il reale impatto dei beta-bloccanti sul rischio di recidiva depressiva. Un aspetto chiave di questa ricerca sarà la corretta interpretazione del bias protopatico: molti pazienti ricevono beta-bloccanti per sintomi iniziali di ansia o tremori, i quali potrebbero rappresentare una fase prodromica di un disturbo dell’umore ancora non diagnosticato. Identificare con precisione questi casi permetterebbe di ottimizzare le scelte terapeutiche, evitando di attribuire erroneamente alla terapia effetti depressogeni che potrebbero, in realtà, essere manifestazioni della patologia sottostante.
2-Analisi genetiche e personalizzazione della terapia
Un altro campo di grande interesse riguarda la farmacogenetica, ovvero la possibilità di personalizzare la terapia con beta-bloccanti in base alle caratteristiche genetiche individuali. Alcuni polimorfismi del CYP2D6, l’enzima coinvolto nel metabolismo di propranololo e metoprololo, influenzano significativamente la biodisponibilità del farmaco, determinando una maggiore o minore esposizione ai suoi effetti. Studi futuri potrebbero identificare varianti genetiche associate a un più alto rischio di effetti neuropsichiatrici, consentendo di selezionare non solo il beta-bloccante più adatto, ma anche il dosaggio ottimale per ciascun paziente. Questo approccio sarebbe particolarmente utile nei metabolizzatori lenti, che potrebbero accumulare concentrazioni plasmatiche più elevate del farmaco, aumentando il rischio di effetti collaterali centrali come affaticamento e alterazioni dell’umore.
3-Sviluppo di strumenti diagnostici più accurati
Uno dei problemi principali nella gestione clinica è la difficoltà nel distinguere tra sintomi depressivi veri e propri e manifestazioni somatiche secondarie alla terapia o alla patologia cardiovascolare. Per affrontare questa sfida, sarebbe fondamentale sviluppare strumenti diagnostici più specifici, tra cui:
- Scale di valutazione differenziale: Strumenti come il PHQ-9 potrebbero essere adattati per discriminare meglio tra sintomi aspecifici (astenia, insonnia) e sintomi nucleari della depressione (anedonia, sentimenti di colpa). L’inclusione di item specifici sul contesto cardiologico permetterebbe di evitare diagnosi erronee e trattamenti inappropriati.
- Biomarcatori oggettivi: L’integrazione di dati biologici nella valutazione clinica potrebbe rappresentare una svolta. Livelli ridotti di BDNF (fattore neurotrofico cerebrale) sono stati associati a depressione maggiore, mentre un aumento del cortisolo può indicare una risposta da stress correlata alla malattia cardiovascolare piuttosto che una depressione primaria. Analogamente, marcatori infiammatori potrebbero fornire ulteriori elementi per distinguere tra affaticamento di origine cardiaca e depressione vera e propria.
Conclusioni
La lunga controversia sul legame tra beta-bloccanti e depressione ha radici in osservazioni iniziali che, seppur comprensibili, non trovano conferma nelle evidenze scientifiche più rigorose. Gli studi su larga scala e le meta-analisi concordano: non esiste un nesso causale tra l’uso di questi farmaci e l’insorgenza di depressione maggiore.
L’eccezione del propranololo, spesso associato a un rischio apparentemente aumentato, si spiega con il contesto in cui viene prescritto—come l’ansia o i tremori—dove i sintomi neuropsichiatrici preesistenti possono essere erroneamente attribuiti al farmaco.
Per i clinici, il messaggio è chiaro: i beta-bloccanti rimangono una terapia cardine in cardiologia, con benefici dimostrati nella riduzione della mortalità e nel miglioramento della qualità di vita. Privare i pazienti di questi farmaci per timori legati alla depressione significa esporli a rischi cardiovascolari maggiori di quelli teorici. Monitorare effetti come affaticamento o insonnia, comuni ma transitori, è sufficiente per garantire sicurezza.
Ai pazienti, va spiegato con chiarezza che stanchezza o alterazioni del sonno non equivalgono a depressione. La comunicazione trasparente è chiave per superare paure infondate e favorire l’aderenza alla terapia.
La scienza oggi ci dice che, salvo casi specifici legati a condizioni neurologiche sottostanti, i beta-bloccanti sono alleati della salute, non nemici del benessere mentale.
Bibliografia
- Bornand, D., Reinau, D., Jick, S. S., & Meier, C. R. (2022). β-Blockers and the Risk of Depression: A Matched Case-Control Study. Drug Safety, 45(4), 359-368.
- Riemer, T. G., Villagomez Fuentes, L. E., Algharably, E. A. E., Schäfer, M. S., Mangelsen, E., Fürtig, M. A., Bittner, N., Bär, A., Zaidi Touis, L., Wachtell, K., Majic, T., Dinges, M. J., & Kreutz, R. (2021). Systematic Review and Meta-Analysis of Psychiatric Adverse Events During β Blocker Therapy. Hypertension, 77(5), 1539–1548.
- Verbeek, D. E. P., van Riezen, J., de Boer, R. A., van Melle, J. P., & de Jonge, P. (2011). A Review on the Putative Association Between Beta-Blockers and Depression. Heart Failure Clinics, 7(1), 1-10.
- Li Y, Fan Y, Sun Y, Alolga RN, Xiao P, Ma G. Antihypertensive Drug Use and the Risk of Depression: A Systematic Review and Network Meta-analysis. Front Pharmacol. 2021 Nov 8;12:777987


























